Sifat dan pembentukan asam karboksilat
1. Asam Karboksilat
Gabungan gugus karbonil dan gugus hidroksil pada atom karbon yang sama disebut gugus karboksil. Senyawa yang mengandung gugus karboksil dikatakan memiliki sifat asam dan disebut asam karboksilat.
Asam karboksilat diklasifikasi sesuai dengan substituen yang terikat pada gugus karbonil. Asam alifatik memiliki gugus alkil yang terikat pada gugus karboksil, sedangkan asam aromatik memiliki gugus aril. Asam yang paling sederhana adalah asam format dengan sebuah proton terikat pada gugus karboksil. Asam lemak merupakan asam alifatik rantai panjang yang diturunkan dari hasil hidrolisis lemak dan minyak.
Asam karboksilat melepaskan proton yang dihasilkan dari pemutusan heterolitik ikatan O-H dan ion karboksilat.
2. Struktur dan Sifat-Sifat Fisika Asam Karboksilat
Struktur yang paling stabil asam format dapat digambarkan :
Keseluruhan molekul hampir planer. Orbital hibrida sp2 atom karbon karbonil adalah planer, dengan sudut ikat hampir trigonal. Ikatan O-H yang terletak pada bidang yang sama, eklips terhadap ikatan C=O. Konfirmasi eklips merupakan bentuk yang paling stabil. Bentuk resonansi yang ditunjukkan oleh asam format memberikan keterangan adanya pasangan elektron yang bersifat delokal.
*Titik Didih
Asam karboksilat yang berat molekulnya hampir sama dengan alkohol, aldehida atau keton mendidih pada suhu yang lebih tinggi. Contoh asam format (berat molekul 46) mendidih pada 100,5°C, sedangkan etanol (berat molekul 46) mendidih pada 78°C, serta asetaldehida (berat molekul 44) mendidih pada 21°C. Hal ini disebabkan oleh gugus karboksil yang mengandung gugus C=O dan gugus O-H yang keduanya bersifat polar. Asam karboksilat dalam fasa air maupun uap berada dalam keadaan dimer. Keadaan ini ditunjukkan dengan adanya ikatan hidrogen intermolekul antara C=O dari satu molekul dengan gugus O-H dari molekul lain.
*Kelarutan Asam Karboksilat
Kelarutannya asam karboksilat dalam air mirip dengan alkohol yang sesuai. Asam karboksilat dengan 4 atom karbon atau kurang dapat larut sempurna dalam air. Kelarutannya disebabkan terjadinya ikatan hidrogen antara gugus karboksil (gugus C=O dan gugus -OH) dengan air. Asam karboksilat dengan 5 atom karbon atau lebih larut sebagian dalam air atau tidak larut.
*Titik Lebur
Asam karboksilat yang mengandung 8 atau lebih atom karbon biasanya berwujud padat kecuali bila mengandung ikatan rangkap. Adanya ikatan rangkap (khususnya ikatan rangkap cis) dalam rantai lurus akan menghalangi terbentuknya kisi-kisi kristal yang stabil. Contohnya asam stearat (asam oktadekanoat) dan asam linoleat (asam cis, cis-9, 12-oktadekanoat) keduanya memiliki 8 atom karbon, asam stearat melebur pada 70°C sedangkan asam linoleat melebur pada -5°C.
3. Sifat Kimia Asam Karboksilat
*Keasaman Asam Karboksilat
Asam karboksilat merupakan senyawa yang memiliki keasaman paling tinggi dalam kelompok senyawa yang hanya mengandung karbon, hidrogen dan oksigen. Bila terionisasi memiliki tetapan keasaman Ka = 10-5 (pKa = 5), yang merupakan asam yang lebih kuat daripada air maupun alkohol. Namun demikian, asam karboksilat merupakan asam lemah. Seperti contoh asam asetat (CH3COOH) 0,1 M dalam air hanya terionisasi 1,3 % . Disosiasi gugus O-H yang terjadi pada asam lebih besar daripada alkohol. Reaksi yang terjadi dapat balik atau dalam keadaan keseimbangan dan tetapan keseimbangan asam. Lazim untuk menentukan keasaman dinyatakan dengan harga pKa = -logika Ka.
Harga pKa untuk asam karboksilat sederhana (Ka = 10-5) sebagai contoh asam asetat (CH3COOH) mempunyai harga pKa = 4,7 (Ka = 1,8 x 10-5) . Dalam asam karboksilat, ion karboksilat yang merupakan sudut trigonal -120° memiliki sifat-sifat elektronik yang khusus. Dua struktur elektronik yang ekivalen (struktur resonansi) dapat digambarkan sebagai anion karboksilat :
*Pengaruh Substituen Terhadap Keasaman
Substituen yang menstabilkan muatan ion negatif asam karboksilat akan menaikkan disosiasi hingga keasaman lebih kuat. Atom atom yang bersifat elektronegatif akan menaikkan kekuatan asam. Pengaruh induksi ini dapat lebih besar bila gugus gugus penarik elektron yang kuat yang terikat pada atom karbon-α lebih dari satu.
Besarnya pengaruh substituen tergantung pada jaraknya dari gugus karboksil. Makin jauh substituen yang terikat pada atom karbon-α pengaruhnya terhadap keasaman makin kecil.
Bila asam format (metanoat) Ka = 1,8x10-4 dengan asam asetat (etanoat) Ka = 1,8x10-5. Terlihat bahwa asam format lebih kuat daripada asam asetat. Gugus metil mendominasi (melepaskan) elektron ke arah gugus karboksil.
Makin banyak gugus alkil yang terikat pada asam karboksilat akan menurunkan keasaman (harga Ka kecil) .
4. Pembuatan Asam Karboksilat
Asam karboksilat dapat dibuat dengan beberapa cara, yaitu :
a). Alkohol primer dan aldehida bila dioksidasi menghasilkan asam karboksilat. Oksidator yang sering digunakan ialah campuran K2Cr2O7 atau Na2Cr2O7 dah H2SO4 yang menghasilkan H2Cr2O4 ,atau menggunakan oksidator KMnO4 dan NaOH. Oksidasi selalu dengan pemanasan dan kemudian menetralisasi dengan asam (H3O+). Oksidasi sering menggunakan tanda [O].
Keadaan yang sama bila alkil benzena dioksidasi akan menghasilkan asam Benzoat.
b). Bila larutan kalium permanganat encer dingin direaksikan dengan alkena akan menghasilkan glikol. Bila larutan permanganat pekat dipanaskan, maka glikol akan teroksidasi lebih lanjut dan terjadi pemutusan ikatan karbon-karbon. Produk yang dihasilkan dapat berupa asam karboksilat atau keton tergantung pada substituen pada ikatan rangkap alkena.
c). Cara Grignard
Pereaksi yang hanya dapat melakukan reaksi adisi terhadap gugus karbonil dari aldehida, keton dan eter. Pereaksi Grignard juga dapat bereaksi dengan CO2 dan bila dilanjutkan dihidrolisis akan diperoleh asam karboksilat dengan jumlah atom karbon bertambah 1. Reaksi keseluruhan :
CO2 yang digunakan dari es kering (dry ice) dan reaksi disebut reaksi karbonasi. Reaksi diawali dengan pembuatan pereaksi Grignard dalam pelarut eter bebas air. Larutan yang diperoleh kemudian dituangkan kedalam es kering, berarti dalam CO2 yang berlebihan. Setelah kelebihan es kering diuapkan, campuran reaksi kemudian diasamkan dengan HCl atau H2SO4 untuk membebaskan asam karboksilat dari garam magnesium. Asam karboksilat akan terdapat pada lapisan eter sedangkan asam mineral dan garam garam anorganik tetap berada dalam lapisan air. Cara ini dapat dilakukan dengan menggunakan alkil halida yang diperoleh dari alkohol primer, sekunder dan tersier.
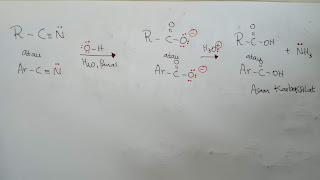
d). Hidrolisis Nitril
Nitril alifatik dan nitril aromatik bila dihidrolisis dalam suasana asam atau basa akan menghasilkan asam karboksilat yang sesuai. Hidrolisis dalam suasana asam :
Hidrolisis dalam suasana basa :
Nitril alifatik dapat dibuat dengan mereaksikan alkil halida dengan NaCN atau KCN dalam pelarut polar seperti alkohol berair.Hanya alkil halida primer atau metil halida yang dapat mengalami reaksi substitusi SN2. Alkil halida sekunder dan tersier mengalami reaksi eliminasi dengan ion sianida pada reaksi E2.
1). Pada sifat fisika titik didih asam karboksilat pada judul sifat fisika dan struktur asam karboksilat. Diterangkan bahwa asam karboksilat memiliki berat molekul yang hampir sama dengan aldehida, alkohol dan keton namun titik didih asam karboksilat lebih tinggi. Seperti dijelaskan bahwa asam format (berat molekul 46) mendidih pada suhu 100,5°C , etanol (berat molekul 46) titik didih 78°C dan asetaldehida (berat molekul 44) titik didih 21°C. Apa yang menyebabkan titik didih asam karboksilat, alkohol, etanol berbeda meskipun berat molekulnya sama yaitu 46?
2). Pada sifat fisika kelarutan pada asam karboksilat pada judul struktur dan Sifat-Sifat fisika asam karboksilat, dijelaskan bahwa kelarutan asam karboksilat dalam air mirip dengan alkohol yang sesuai. Asam karboksilat dengan 4 karbon atau lebih dapat larut sempurna didalam air. Kelarutannya disebabkan oleh terjadinya ikatan hidrogen antara gugus karboksil (gugus C=O dan gugus -OH) dengan air. Sedangkan asam karboksilat dengan 5 atom karbon atau lebih hanya larut sebagian dalam air bahkan tidak larut. Apa yang menyebabkan asam karboksilat dengan 5 atom atau lebih hanya melarut sebagian dalam air bahkan tidak larut?
3). Pada reaksi pembuatan asam karboksilat pada bagian B. Dijelaskan bahwa permanganat encer dingin direaksikan dengan alkena akan menghasilkan glikol. Bila larutan permanganat pekat dipanaskan, maka glikol akan teroksidasi lebih lanjut dan terjadi pemutusan ikatan karbon-karbon. Produk yang dihasilkan dapat berupa asam karboksilat atau keton tergantung pada substituen pada ikatan rangkap alkena.
Substituen yang bagaimana yang harus ditambahkan pada reaksi pada gambar diatas sehingga nanti akan menghasilkan asam karboksilat dan keton?
Jawaban Permasalahan kelantan
d). Hidrolisis Nitril
Nitril alifatik dan nitril aromatik bila dihidrolisis dalam suasana asam atau basa akan menghasilkan asam karboksilat yang sesuai. Hidrolisis dalam suasana asam :
Hidrolisis dalam suasana basa :
Nitril alifatik dapat dibuat dengan mereaksikan alkil halida dengan NaCN atau KCN dalam pelarut polar seperti alkohol berair.Hanya alkil halida primer atau metil halida yang dapat mengalami reaksi substitusi SN2. Alkil halida sekunder dan tersier mengalami reaksi eliminasi dengan ion sianida pada reaksi E2.
Daftar Pustaka
Sastroamidjojo, H. 2010. Kimia Organik Dasar. Yogyakarta : Universitas Gadjah Mada Press
Permasalahan
1). Pada sifat fisika titik didih asam karboksilat pada judul sifat fisika dan struktur asam karboksilat. Diterangkan bahwa asam karboksilat memiliki berat molekul yang hampir sama dengan aldehida, alkohol dan keton namun titik didih asam karboksilat lebih tinggi. Seperti dijelaskan bahwa asam format (berat molekul 46) mendidih pada suhu 100,5°C , etanol (berat molekul 46) titik didih 78°C dan asetaldehida (berat molekul 44) titik didih 21°C. Apa yang menyebabkan titik didih asam karboksilat, alkohol, etanol berbeda meskipun berat molekulnya sama yaitu 46?
2). Pada sifat fisika kelarutan pada asam karboksilat pada judul struktur dan Sifat-Sifat fisika asam karboksilat, dijelaskan bahwa kelarutan asam karboksilat dalam air mirip dengan alkohol yang sesuai. Asam karboksilat dengan 4 karbon atau lebih dapat larut sempurna didalam air. Kelarutannya disebabkan oleh terjadinya ikatan hidrogen antara gugus karboksil (gugus C=O dan gugus -OH) dengan air. Sedangkan asam karboksilat dengan 5 atom karbon atau lebih hanya larut sebagian dalam air bahkan tidak larut. Apa yang menyebabkan asam karboksilat dengan 5 atom atau lebih hanya melarut sebagian dalam air bahkan tidak larut?
3). Pada reaksi pembuatan asam karboksilat pada bagian B. Dijelaskan bahwa permanganat encer dingin direaksikan dengan alkena akan menghasilkan glikol. Bila larutan permanganat pekat dipanaskan, maka glikol akan teroksidasi lebih lanjut dan terjadi pemutusan ikatan karbon-karbon. Produk yang dihasilkan dapat berupa asam karboksilat atau keton tergantung pada substituen pada ikatan rangkap alkena.
Substituen yang bagaimana yang harus ditambahkan pada reaksi pada gambar diatas sehingga nanti akan menghasilkan asam karboksilat dan keton?
Jawaban Permasalahan kelantan
Gambar 1
Gambar 2

























Baiklah saudari siti saya Nur khalishah (052) akn mencoba menjawab permasalahan no 2 yang siti ajukan yakni Menurut saya karna Asam karboksilat bersifat polar. Asam karboksilat rantai kecil (1 sampai 5 karbon) Asam karboksilat dengan 4 karbon atau lebih dapat larut sempurna didalam air di karenakan ia memiliki lebih sedikit atom C sedangkan pada rantai yang lebih panjang seperti asam karboksilat dengan 5 karbon semakin kurang larut karena sifat hidrofobik dari rantai alkil.
BalasHapusERMA JOHAR A1C118031
BalasHapusBaiklah menurut saya , menyebabkan berbeda itu bisa dikarenakan faktor rintangam sterik , faktor struktur molekul dan kereaktifan senyawa itu sehingga dapat mempengaruhi untuk titik didihnya. Terima kasih
Khusnul khotimah (039) akan mencoba menjawab permasalahan no 3. Substituen adalah suatu atom atau gugus yang masuk dalam bangunan sebuah molekul dengan menggantikan atom gugus lain. Nah jadi suatu subtituen disini akan tergantung dengan banyaknya C pada gugus R nya. Substituen disini dapat berupa CH3 ataupun CH2 tergantung lokasi ditempatkannya pada ikatan rangkap alkena
BalasHapus