Derivat Asam Karboksilat
Derivat Asam Karboksilat
Derivat Asam karboksilat merupakan senyawa yang memiliki struktur mirip dengan Asam karboksilat dengan gugus OH digunakan oleh gugus lain. Derivat-derivat itu tidak selalu dihasilkan dari Asam karboksilat, tetapi satu derivat sering dihasilkan dari derivat yang lain. Derivat yang mengandung gugus RC(O) disebut gugus asil. Derivat ini dihasilkan dari reaksi Adisi-eliminasi. Derivat Asam karboksilat mencakup :
Namun pada pembahasan ini akan dibahas 3 saja, yaitu Halida Asam karboksilat, Anhidrida dan Ester.
1). Halida Asam Karboksilat
Halida Asam karboksilat tidak terdapat dialam. Halida ini cukup reaktif sehingga mudah mudah dikonversi dengan Asam induk atau salah satu derivat lainnya.
*Pembuatan Halida Asam Karboksilat
Asam karboksilat merupakan bahan awal untuk membuat halida Asam. Karena gugus OH pada Asam karboksilat bukan merupakan gugus lepas yang baik, gugus tersebut harus dikonversi menjadi gugus lepas yang lebih baik. Tionil klorida (SOCl2) biasanya digunakan untuk mengubah Asam menjadi klorida Asam. Reaksinya :
Pada reaksi tersebut ditunjukkan bahwa gugus OH yang buruk diubah menjadi gugus klorosulfit [OS(O)Cl] yang merupakan gugus baik. Anion klorida berperan sebagai nukleofil pada reaksi SN2 untuk membentuk klorida Asam .Tionil bromida (SOBr2) Fosfor Tri bromida (PBr2) , fosfor triklorida (PCl3), dan oksail klorida [CIC(O) C(O) Cl] merupakan pereaksi lain yang digunakan untuk membuat halida Asam. Reaksi reaksi ini mudah terjadi pada temperatur ruangan (suhu kamar). Basa (B) seperti cincin piridin dan Tri alkil amina digunakan untuk menetralkan produk sampingan hidrogen yang terbentuk pada reaksi ini.
*Reaksi Halida Asam Karboksilat
a). Reaksi dengan Alkohol
Halida Asam mudah bereaksi dengan alkohol untuk menghasilkan ester. Reaksi digambarkan :
Basa (B) biasanya digunakan untuk menetralkan produk sampingan hidrogen halida. Karena efek sterik, alkohol primer bereaksi lebih cepat dibanding alkohol sekunder yang bereaksi lebih cepat daripada alkohol tersier. Ester dapat dibuat dari ketiga jenis alkohol, tetapi sulit membuat ester dari alkohol tersier yang besar.
b). Reaksi dengan Air
Halida Asam karboksilat mudah bereaksi dengan air menghasilkan Asam karboksilat yang sesuai strukturnya. Reaksi digambarkan :
Reaksi ini umumnya tidak bermanfaat karena Asam karboksilat biasanya digunakan untuk membuat halida Asam. Namun, jika terdapat air sebagai pengotor, air dapat bereaksi dengan klorida Asam dan bersaing dengan reaksi substitusi asil nukleofilik yang dituju.
c). Reaksi dengan Asam karboksilat
Halida bereaksi dengan Asam karboksilat menghasilkan anhidrida. Reaksi :
Karena dihasilkan hidrogen halida sebagai produk sampingan, basa (piridin atau amina tersier) biasanya digunakan untuk menetralkan.
d). Reaksi dengan Amina
Halida Asam bereaksi dengan amina sekunder menghasilkan amida. Reaksinya :
Atom nitrogen amina setidaknya harus mengikat satu atom hidrogen untuk pembentukan amida. Amina tersier tidak membentuk amida karena tidak ada atom hidrogen yang terikat ke atom nitrogen. Amina primer membentuk imida. Reaksinya :
Amina primer dapat bereaksi dengan halida Asam membentuk amida jika digunakan amina primer berlebihan.
e). Reaksi Reduksi
Klorida Asam direduksi oleh LiAlH4 atau LAH menjadi alkohol primer. Reaksinya :
Pereaksi preduksi hidrida yang kurang aktif [litium tri-(tert-butoksi)] alumunium hidrida, mereduksi halida Asam sampai menjadi aldehida dan bukan menjadi alkohol. Reaksinya :
f). Reaksi dengan Pereaksi Organologam
Pereaksi Grignard (RMgX) mulai mulai bereaksi dengan halida Asam menghasilkan keton.
Keton sulit dipisahkan karena cepat bereaksi kembali dengan pereaksi Grignard menghasilkan anion alkoksida tersier. Reaksi ini terjadi dengan 2 ekivalen pereaksi Grignard untuk menghasilkan anion alkoksida tersier secara langsung.
Selanjutnya adisi Memprotonasi anion alkoksida menghasilkan alkohol tersier yang sesuai.
2. Anhidrida Asam Karboksilat
* Sintesis anhidrida
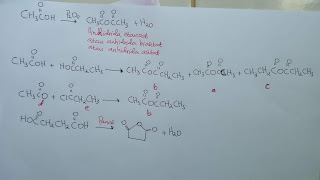
Anhidrida (tanpa air). Dua molekul Asam karboksilat dapat bereaksi menghilang molekul air menghasilkan anhidrida. Pereaksi pendehidrasi seperti P2O3 digunakan untuk sintesis anhidrida. Pembuatan anhidrida ditunjukkan :
Dehidrasi campuran Asam asetat dan Asam. Propionat menghasilkan 3 anhidrida : anhidrida asetat, anhidrida asetat propionat, dan anhidrida propionat. Metode pembuatan anhidrida campuran yang lebih baik adalah mereaksikan halida Asam dengan garam Asam karboksilat. Metode ini dapat digunakan untuk membuat anhidrida simetris dan campuran. Reaksi anion asetat (d) dengan propiopil klorida (e) menghasilkan anhidrida asetat propionat (b). Anhidrida siklik cincin-lima dan cincin-enam dapat dibuat dari Asam dikarboksilat yang sesuai. Pemanasan Asam suksinat (f) hingga suhu sekitar 200°C menghasilkan anhidrida suksinat (g).
*Reaksi Anhidrida
a) Reaksi dengan Alkohol
Ester dapat dibuat melalui reaksi anhidrida dengan alkohol. Anhidrida mudah bereaksi dengan alkohol tersier, sekunder dan primer yang digambarkan :
b). Reaksi dengan Air
Air bereaksi dengan anhidrida campuran membentuk 1 ekivalen untuk masing-masing dari 2 Asam karboksilat yang berbeda seperti gambar :
Jika suatu anhidrida simetris dihidrolisis, terbentuk 2 ekivalen Asam karboksilat yang sama. Reaksi ini kurang bermanfaat, karena Asam karboksilat yang sering digunakan sebagai bahan awal pembuatan anhidrida.
c). Reaksi dengan Amina
Anhidrida bereaksi dengan amina sekunder menghasilkan amida. Setengah dari anhidrida juga terbuang dari reaksi ini. Satu ekivalen anhidrida yang bereaksi membentuk amida dan lainnya membentuk garam amonium karboksilat seperti gambar :
d). Reaksi Reduksi
Anhidrida direduksi oleh LAH menghasilkan alkohol primer dari setiap separuh anhidrida. Anhidrida simetris (R=R') menghasilkan 1 produk sedangkan anhidrida campuran menghasilkan 2 alkohol primer yang berbeda. Reaksinya :
3). Ester Karboksilat
Banyak ester karboksilat tersedia di alam dan lebih banyak lagi yang sudah dibuat di laboratorium. Banyak ester memiliki aroma yang enak dan digunakan dalam parfum. Isopentil asetat beraroma seperti pisang dan metil butirat beraroma seperti nanas.
*Sintesis Ester
Ester dibuat dari halida Asam seperti pada gambar :
Pada gambar tersebut ditunjukkan bahwa asam karboksilat bereaksi dengan alkohol primer, sekunder dan tersier menghasilkan ester. Reaksi ini dikatalisis oleh Asam kuat . Asam karboksilat terprotonasi bereaksi dengan alkohol menghasilkan kation tetrahedral. Oksigen OH mengalami protonasi (OH2+) sehingga mengubah OH menjadi gugus lepas yang lebih baik. Zat zat ini menghilangkan molekul air dan menghasilkan ester setelah protonasi. Pembentukan ester yang dikatalisis oleh Asam disebut Esterifikasi fisher.
*Reaksi Ester
a). Reaksi dengan air
Reaksi ester dengan air disebut hidrolisis. Reaksi ini sangat lamban, kecuali dikatalisis oleh Asam atau basa. Reaksi ester dengan air ditunjukkan oleh :
Pada gambar tersebut ditunjukkan bila ester dikatalisis oleh basa disebut saponifikasi atau penyabunan. Ester tersier dihidrolisis lebih cepat daripada ester sekunder dan primer. Hal ini dikarenakan ester tersier merupakan gugus ester yang besar dan juga gugus lepas yang lebih baik daripada gugus ester yang tidak terlalu besar (ester primer dan sekunder). Pada hidrolisis ester yang dikatalisis oleh Asam, gugus lepas tersier merupakan karbokation. Karbokation bereaksi dengan air menghasilkan alkohol terprotonasi yang di protonasi menjadi alkohol tersier.
b). Reaksi dengan Alkohol
Pada reaksi alkohol dengan ester, terjadi pertukaran gugus alkoksida atau ariloksi. Reaksi ini ditunjukkan oleh gambar :
Reaksi ini dikatalisis oleh Asam dan disebut transferifikasi. Kesetimbangan dikontrol dengan penambahan sejumlah besar alkohol berlebihan untuk pertukaran atau dengan mengeluarkan (dengan distilasi) alkohol yang terbentuk pada pertukaran ester. Cara ini sering dilakukan untuk pembuatan ester baru dari ester yang sudah tersedia.
Daftar Pustaka
Leswara. N. D. 2006. Menyingkap Tabir Kimia Organik. Jakarta : Penerbit Buku Kedokteran EGC
Permasalahan
1). Pada reaksi ester dengan alkohol pada bagian b reaksi ester dari judul reaksi ester. Dijelaskan bahwa ester direaksikan dengan alkohol seperti gambar :
Reaksi ini dikatalisis oleh Asam dan disebut transferifikasi. Kesetimbangan dikontrol dengan penambahan sejumlah besar alkohol berlebihan untuk pertukaran atau dengan mengeluarkan (dengan distilasi) alkohol yang terbentuk pada pertukaran ester. Apa yang terjadi bila digunakan alkohol yang terbatas pada reaksi ester dan alkohol tersebut?
2). Pada judul ester karboksilat, dijelaskan bahwa "Banyak ester karboksilat tersedia di alam dan lebih banyak lagi yang sudah dibuat di laboratorium. Banyak ester memiliki aroma yang enak dan digunakan dalam parfum. Isopentil asetat beraroma seperti pisang dan etil butirat beraroma seperti nanas". Bagaimana reaksi sintesis dari etil butirat sehingga beraroma seperti nanas?
3). Pada reaksi sintesis ester yang ditunjukkan oleh gambar :
Pada gambar tersebut dijelaskan bahwa "asam karboksilat bereaksi dengan alkohol primer, sekunder dan tersier menghasilkan ester. Reaksi ini dikatalisis oleh Asam kuat . Asam karboksilat terprotonasi bereaksi dengan alkohol menghasilkan kation tetrahedral. Oksigen OH mengalami protonasi (OH2+) sehingga mengubah OH menjadi gugus lepas yang lebih baik". Bagaimana jika reaksi tersebut dikatalisis oleh Asam lemah, dan bagaimana produk yang terbentuk?























Komentar ini telah dihapus oleh pengarang.
BalasHapusHai siti
BalasHapusSaya M Rizki Dwi Putra NIM A1C118006 Menjawab permasalahan nomor 1, apabila digunakan alkohol berlebih dalam reaksi transesterifikasi maka hasil rendemen ester yang didapat tinggi sedangkan apabila menggunakan alkohol dalam jumlah terbatas menurut saya rendemen ester yang dihasilkan kurang.
WISLIANA (A1C118060)
BalasHapus3. Perlu untuk diketahui bahwa mekanisme reaksi esterifikasi merupakan reaksi substitusi asil nukleofil dengan katalisator asam. Karena Gugus karbonil dari asam kaboksilat tidak cukup kuat sebagai elektrofil untuk diserang olah alkohol, dengan adanya Katalisator asam dalam hal ini sering digunakan asam yang kuat seperti HCl dan H2SO4 akan memprotonasi gugus karbonil dan mengaktivasinya ke arah penyerangan nukleofil. Sehingga menyebabkan lepasnya proton yang akan menghasilkan hidrat dari ester, kemudian terjadi transfer proton. Jika yang digunakan ialah asam lemah maka akan berdampak pada kurang baiknya proses katalis asam ini sehingga protonasi gugus karbonil dan mengaktivasinya ke arah penyerangan nukleofil juga tidak efektif dan lepasnya proton yang akan menghasilkan hidrat dari ester, juga tidak sebaik jika yang digunakan asam kuat. Tanpa katalis asam, reaksi sangat lambat. Jadi, jika digunakan katalis asam lemah maka akan berpengaruh kepada proses reaksi dan produk yang yang dihasilkan juga akan tidak sebaik dengan jika yang digunakan ialah asam kuat.
Terima kasih
Ermawati ( A1C118002)
BalasHapusSaya Ermawati ingin mencoba menjawab permasalahan nomor 2 yang saudari ajukan.
Sintesis etil butirat Ini dapat dihasilkan dari reaksi etanol dan asam butirat. Ini adalah reaksi kondensasi artinyaair adalah produksi dalam reaksi seperti biproduk. Untuk membuat dan mengidentifikasi etil butirat, bahan yang diperlukan adalah 18,4 mL (0,2 mol) asam butirat dan etil alkohol sebanyak 23,3 mL (0,4 mol). Alat yang digunakan untuk metode analisis ini adalah reflux, alat distilasi sederhana, spektrofotometer, dan kromatografi gas. Alkohol (etil alkohol) akan dicampur dengan asam karboksilat (asam butirat) menggunakan reflux dan menghasilkan senyawa aroma, yaitu ester. Ester yang terbentuk tidak murni, sehingga perlu dilakukan distilasi sederhana untuk mendapatkan senyawa ester murni yang ingin dianalisa, yaitu etil butirat. Setelah etil butirat murni diperoleh, identifikasi etil butirat dilakukan dengan menggunakan spektrofotometer. Kemurnian etil butirat yang diperoleh dianalisis dengan menggunakan kromatografi gas. Analisis kandungan etil butirat pada pangan, seperti buah nanas, dapat dilakukan dengan headspace-solid phase microextraction (HS-SPME) dan gas chromatography-mass spectrometry (GC/MS)
Terimakasih.